非アルコール性脂肪性肝炎(NASH)は、承認された治療法がない進行性の肝疾患です。レスメチロム Resmetirom は、肝線維化を伴うNASH の治療のために開発されている経口の肝臓指向性の甲状腺ホルモン受容体 β 選択的アゴニストです。
肝生検によって確認された線維化ステージ F1B、F2、F3 の NASH 患者を対象とした第 3 相試験が実施されています。患者は、1 日 1 回 80mg または 100mg のレスメチロム、またはプラセボを受け取るように 1:1:1 の割合でランダムに割り当てられました。主要評価項目は、52 週時点で肝線維化の悪化を伴わずに NASH が解消(NAFLD activity score の 2 点以上の減少を含む)すること、および NAFLD activity score の悪化を伴わずに肝線維化が少なくとも 1 段階改善することでした。
全体で、966人の患者が解析対象となりました(80mg レスメチロム群 322 人、100mg レスメチロム群 323 人、プラセボ群 321 人)。肝線維化の悪化を伴わない NASH 解消は、80mg レスメチロム群の患者の 25.9 %と 100mg レスメチロム群の患者の 29.9 %で達成されましたが、プラセボ群では 9.7 %でした(P<0.001)。NAFLD activity scoreの悪化を伴わない 1 段階以上の肝線維化改善は、80mgレスメチロム群の患者の 24.2 %と 100mg レスメチロム群の患者の 25.9 %で達成されましたが、プラセボ群では 14.2 %でした(P<0.001)。ベースラインから 24 週時点までの LDL コレステロールレベルの変化は、80mg レスメチロム群で -13.6 %、100mg レスメチロム群で -16.3 %でしたが、プラセボ群では 0.1 %でした(P<0.001)。下痢と吐き気は、プラセボよりもレスメチロム群でより多く観察されました。重篤な有害事象の発生率は、試験群間で差はありませんでした:80mg レスメチロム群で 10.9 %、100mg レスメチロム群で 12.7 %、プラセボ群で 11.5 %。
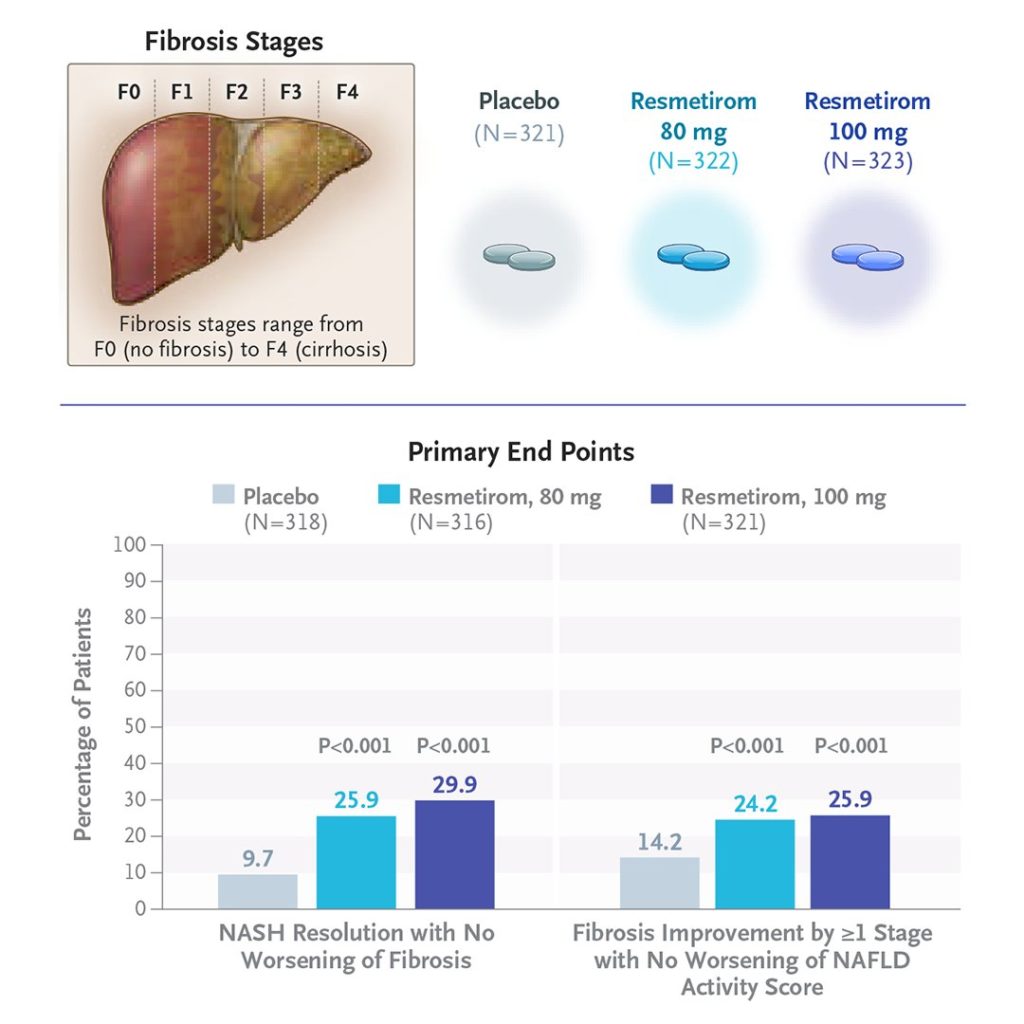
レスメチロムの 80mg 用量と 100mg 用量は、NASH 解消と 1 段階以上の肝線維化の改善に関してプラセボよりも優れていました。レスメチロムの長期使用の安全性はまだ評価されていません。この試験は、肝硬変への進行を含む肝臓関連の転帰を評価するために、54 か月まで継続される予定です。